活体成像技术驱动基因治疗疗效评估的跨尺度可视化方案
基因治疗通过直接修正致病基因或调控基因表达来治疗疾病,已成为癌症、遗传病等领域的重要突破方向。然而,如何精准评估治疗效果、追踪治疗载体在体内的动态分布,仍是科研与临床转化的核心挑战。活体成像技术凭借其非侵入性、动态可视化能力,正推动基因治疗疗效评估从“间接推测”迈向“跨尺度实证”,为这一领域注入全新方法论。
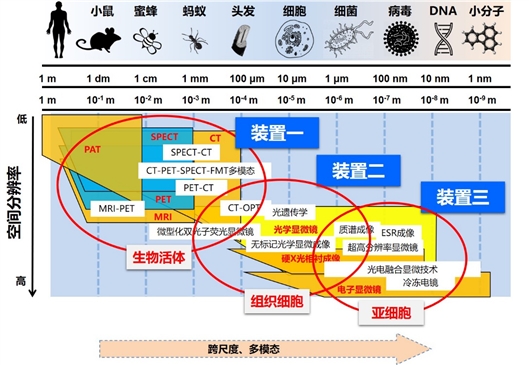
技术基石:从分子到器官的全尺度成像
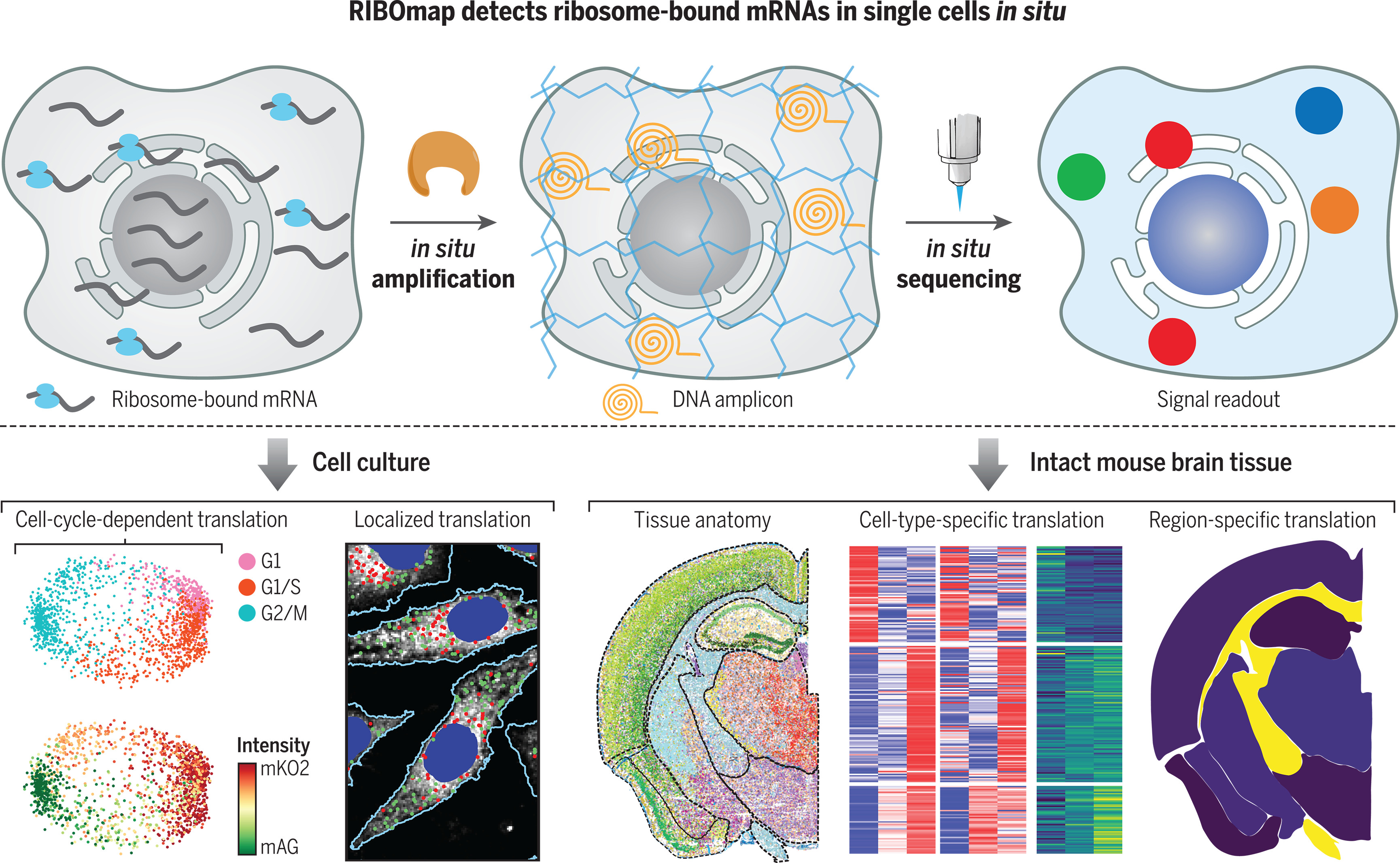
分子尺度:利用CRISPR基因编辑结合荧光报告系统,可实时观测内源基因的转录活性与核定位动态。例如,日本团队开发的ROLEX技术通过CRISPR与荧光标记结合,实现了小鼠胚胎干细胞中多能性基因的转录活性与空间定位同步成像,为基因编辑效率提供分子级证据;
细胞尺度:超分辨活体成像技术突破光学衍射极限,以131nm横向分辨率追踪基因载体在细胞内的运输路径,甚至可观察线粒体等细胞器对治疗载体的代谢响应;
组织器官尺度:磁性粒子成像(MPI)通过高灵敏度磁性探针,可在全身范围内无背景干扰地追踪基因治疗载体的分布。其灵敏度高达5ng,可检测毫米级肿瘤病灶,并实时评估载体在肝、脑等深部器官的富集效率;
系统尺度:多模态跨尺度成像设施整合光、声、磁等多模态技术,从基因表达动态到器官功能变化实现全景式关联分析,为基因治疗的系统性毒性评估提供支持。
应用场景:疗效评估的精准化突破
1. 载体递送效率的可视化验证
基因治疗依赖病毒载体或纳米颗粒将治疗基因递送至靶组织。传统方法需处死动物进行组织切片,而活体成像技术可动态追踪载体分布:
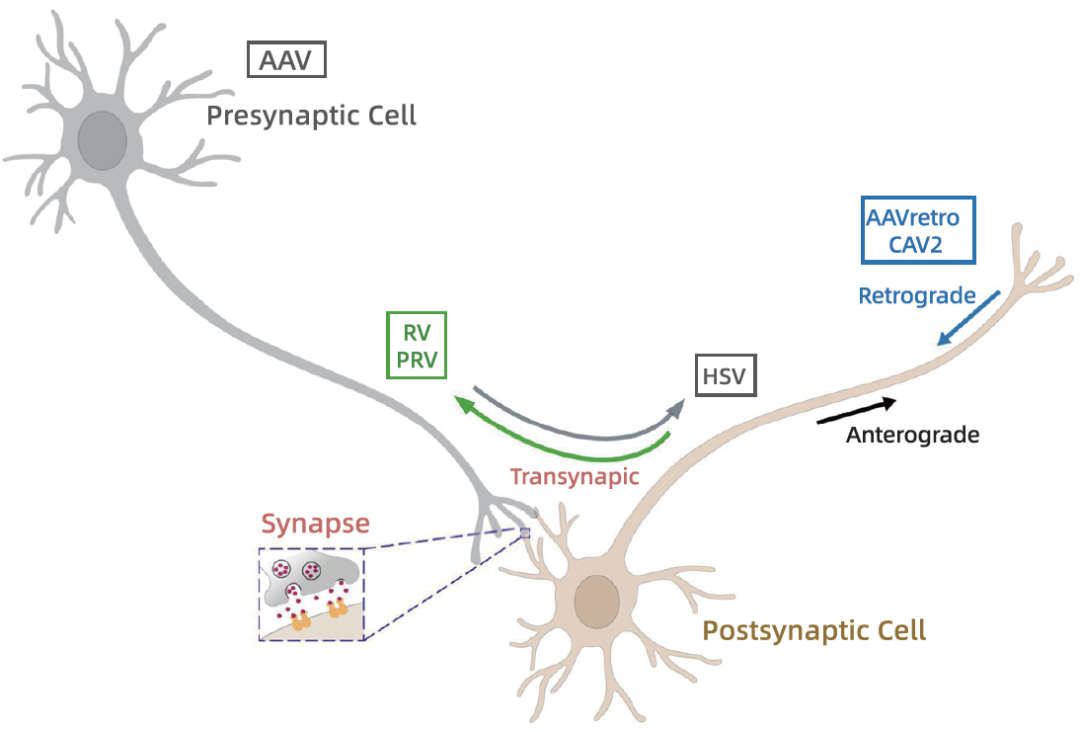
AAV载体追踪:通过荧光标记或磁性探针修饰AAV衣壳,结合双光子显微或MPI技术,可实时观测病毒穿透血脑屏障、感染神经元的全过程,优化给药剂量与路径;
纳米颗粒代谢:近红外二区(NIR-II)成像可穿透数厘米组织,监测脂质纳米颗粒在肝脏的代谢滞留时间,避免载体过量引发的肝毒性。2. 基因编辑效能的动态评估
CRISPR-Cas9等基因编辑工具的脱靶效应是重大安全隐患。活体成像通过以下策略提升评估精度:
双报告系统:在靶基因和潜在脱靶位点同步插入荧光素酶与荧光蛋白,利用生物发光成像(高灵敏度)与荧光成像(高空间分辨率)交叉验证编辑特异性;
表观遗传响应:通过磁共振成像(MRI)探针标记组蛋白修饰变化,间接反映基因编辑对染色质结构的全局影响。3. 治疗响应的多维度关联
基因治疗的疗效不仅取决于靶基因修正,还需评估免疫应答、代谢重编程等伴随效应:
免疫细胞迁移:标记CAR-T细胞中的荧光素酶,可实时观测其向肿瘤部位的浸润速度与持久性,结合血氧饱和度成像(sO2)评估肿瘤微环境代谢变化,预测治疗响应;
毒性预警:通过SPECT/CT成像同步监测治疗引发的组织凋亡,早期发现肝、肾等器官的细胞毒性,优化治疗方案。
挑战与未来:从技术革新到临床落地
现存瓶颈
穿透深度与分辨率的矛盾:深部器官成像需长波长光源(如NIR-II),但分辨率受限;超分辨技术虽精度高,却难以穿透厚组织;
动态追踪的算力需求:高帧率成像产生的TB级数据对实时处理算法提出挑战,需边缘计算与AI压缩技术协同突破。
前沿方向
智能探针开发:
可激活式探针:仅在基因编辑成功时释放荧光信号,减少背景干扰;
多模态探针:整合磁性、荧光、光声特性,一次注射即可支持MRI、光学、超声等多模态成像,全面评估治疗效应;
数字孪生与AI预测:
通过多模态成像数据构建“数字器官”模型,模拟基因治疗后的代谢与功能变化,提前预测疗效与毒性;
AI算法自动识别治疗响应标志物(如肿瘤血管正常化、免疫细胞浸润模式),为个性化治疗提供决策支持;
临床转化加速:
微型化成像设备(如2.2克双光子显微镜)支持术中实时导航,指导基因编辑载体的精准注射;
可穿戴超声贴片实现自由活动动物的长期监测,推动基因治疗从实验室向床边应用跨越。
结语
活体成像技术正重塑基因治疗疗效评估的范式——从分子事件的微观捕捉到全身效应的宏观解析,从静态切片到动态电影,从经验驱动到数据驱动。随着多模态融合、智能探针与AI分析的深度整合,未来基因治疗将真正实现“可视可调可控”,为攻克疑难疾病开启精准医学的新纪元。
