活体成像技术伦理审查的核心要点与国际标准对标
活体成像技术凭借其非侵入性、动态可视化能力,已成为生命科学研究的核心工具。然而,随着技术应用场景的扩展(如基因治疗、胚胎发育观测、神经科学研究等),伦理审查的复杂性显著增加——既要保障受试者(人或实验动物)的权益,又要平衡科研探索的边界。本文从伦理审查的核心要点出发,结合国际标准与国内实践,解析如何在科学创新与伦理合规间找到平衡点。
伦理审查的核心框架
1. 受试者权益优先原则
无论是人体研究还是动物实验,伦理审查的首要目标是保护受试者的生命健康与尊严。在人体活体成像中,需严格遵循《赫尔辛基宣言》的“风险最小化”原则,确保研究风险不超越潜在受益89。例如,在人类胚胎成像中,美国宾夕法尼亚大学团队采用非基因改造的荧光染料技术,避免了对胚胎的遗传干预,同时通过捐赠胚胎的严格筛选与知情同意流程,确保研究符合伦理规范;
2. 知情同意与隐私保护
人体研究:需明确告知受试者成像技术的用途、潜在风险及数据使用范围。例如,全身PET/CT研究中,澳大利亚国家全身PET中心要求知情同意书明确说明“偶发发现”的处理流程,仅对威胁生命的异常启动临床转诊,避免过度医疗;
动物实验:遵循“3R原则”(替代、减少、优化)。清华大学RUSH3D系统通过低光毒性与高速成像技术,将小鼠连续观测时间从数小时延长至数十小时,减少重复实验的动物使用量;
3. 数据安全与跨机构共享
活体成像数据常包含敏感生物信息(如基因表达模式、疾病标志物)。国内《涉及人的生命科学和医学研究伦理审查办法》要求数据匿名化处理,并通过加密存储、权限分级控制泄露风险8。国际标准(如欧盟GDPR)进一步要求数据跨境传输时需获得明确授权;
4. 利益冲突与透明度管理
研究资助方、设备厂商的利益关系可能影响结果客观性。伦理委员会需审查研究者是否披露利益冲突,并通过第三方复核(如多中心数据验证)确保结论可信。
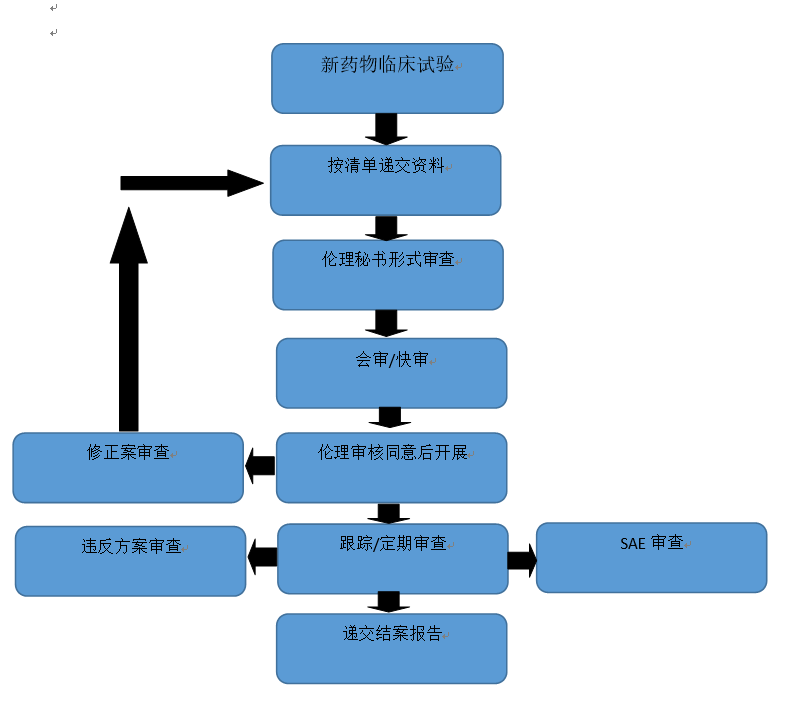
国际标准与中国实践的深度对标
活体成像技术的伦理审查需遵循以下核心原则:
1. 国际标准:赫尔辛基宣言与CIOMS指南
风险控制:国际医学科学组织理事会(CIOMS)要求研究方案必须包含风险应急预案。例如,在活体成像中发现未确诊肿瘤时,需提供临床转诊路径;
特殊群体保护:对儿童、孕妇等群体的研究需额外审查。美国胚胎成像研究中,仅使用发育早期(60-100细胞阶段)的捐赠胚胎,并排除可能形成器官的样本,避免伦理争议。
2. 中国规范:精细化与实操性提升
2023年发布的《涉及人的生命科学和医学研究伦理审查办法》明确提出:
分级审查机制:根据风险等级(如基因治疗 vs. 常规成像)调整审查强度,高风险项目需省级伦理委员会复核;
技术适配性:针对新型成像技术(如近红外二区、介观成像),要求审查其对受试者的长期影响。例如,恒光智影MARS系统通过高穿透深度(15mm)减少组织损伤,符合“优化”原则。
3. 国际案例与中国创新的融合
偶发发现管理:澳大利亚国家全身PET中心采用“技师初筛 + 放射科转诊”模式,将偶发发现的临床评估成本降低70%,为中国多中心研究提供参考;
动物福利强化:欧洲《动物实验指令》要求活体成像中麻醉深度实时监测。科辰星飞等国内企业已推出集成生理参数反馈的智能麻醉系统,将动物死亡率从8%降至0.5%。
_20250530103739A994.jpg)
未来挑战与伦理技术协同进化
AI与自动化:AI辅助图像分析可减少人为偏倚,但算法透明度不足可能掩盖错误。需建立AI模型的伦理评估流程,如训练数据代表性审查;
可穿戴设备:柔性超声贴片等设备支持自由活动动物成像,但长期监测可能干扰自然行为。需制定“最小干扰”操作标准;
2. 全球化协作与标准统一
数据互认:通过区块链技术实现多中心数据溯源,确保符合各国隐私法规(如GDPR与中国《个人信息保护法》);
伦理审查互认:借鉴医疗器械领域的CE/FDA互认机制,推动跨国研究项目的伦理审查结果共享,减少重复审批;
3. 公众参与与伦理教育
知情同意创新:采用可视化工具(如3D动画)向受试者解释成像过程,提升知情质量;
伦理培训常态化:医疗机构与科研机构需定期开展伦理培训,覆盖技术人员、学生及管理者,形成伦理合规文化。
