研究背景:ALI/ARDS治疗的瓶颈
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是重症监护室中高死亡率的主要原因之一。如果不进行有效干预,受损的肺泡上皮细胞(AECs)会导致肺泡-毛细血管屏障破坏,并最终发展为不可逆的肺纤维化。这一过程涉及复杂的细胞内线粒体稳态失衡(氧化应激和钙超载)以及细胞外的炎症风暴。
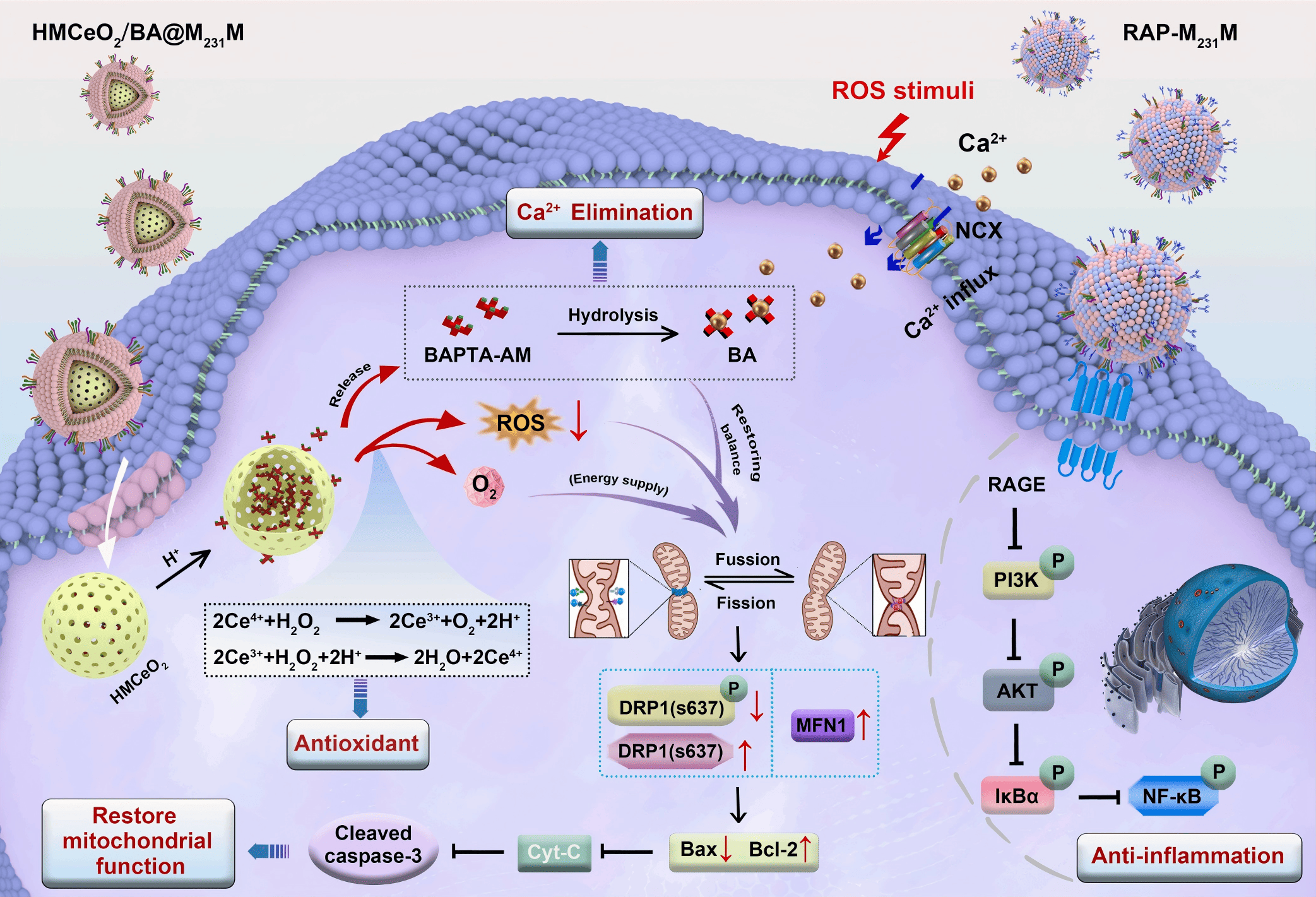
核心挑战:如何实现多靶点协同治疗与精准递送?
研究团队面临的主要挑战在于:如何设计一种单一载体,既能进入细胞内部清除ROS并螯合过量的钙离子,又能在细胞外部阻断炎症信号通路。此外,如何证明这种复杂的纳米药物在体内能够真正靶向受损的肺部组织,而不是被肝脏等器官快速代谢,是验证其疗效的关键前提。
技术路径解析与科辰星飞解决方案
为了验证纳米药物的生物分布(Biodistribution),中国海洋大学与江西中医药大学联合研究团队使用了近红外荧光染料 DiR 和红色荧光染料 RhoB 标记纳米颗粒,并在不同时间点对小鼠主要器官进行了离体荧光成像(Ex vivo NIR imaging)。实验结果清晰地展示了药物随时间推移在肺部的显著富集。
这一环节正是小动物活体荧光成像技术的典型应用场景。科辰星飞的LumiFluor AVIS X 6 小动物活体成像系统专为多色荧光与近红外成像优化,具备极高的检测灵敏度和光谱分离能力。对于此类涉及 DiR(近红外)和 RhoB(可见光)多通道标记的实验,AVIS X 6 能够清晰区分不同染料的信号,精准定量药物在肺、肝、脾等器官的分布比例,为药物的靶向性提供坚实的数据支持。
使用 LumiFluor AVIS X 6 复现实验核心步骤
- 探针标记:利用 DiR 或 RhoB 荧光染料对制备好的纳米颗粒(如 HMCeO2@M231M)进行物理包载或化学偶联标记。
- 模型给药:建立 LPS 诱导的 ALI 小鼠模型,通过尾静脉注射荧光标记的纳米药物。
- 时序成像:在注射后 1h、3h、6h、12h、24h 等时间点,利用 LumiFluor AVIS X 6 系统对离体器官(或进行活体全身扫描)进行荧光成像。选择对应的滤光片组(如 DiR 选用 710nm/780nm),获取高信噪比图像并进行辐射效率(Radiant Efficiency)定量分析。
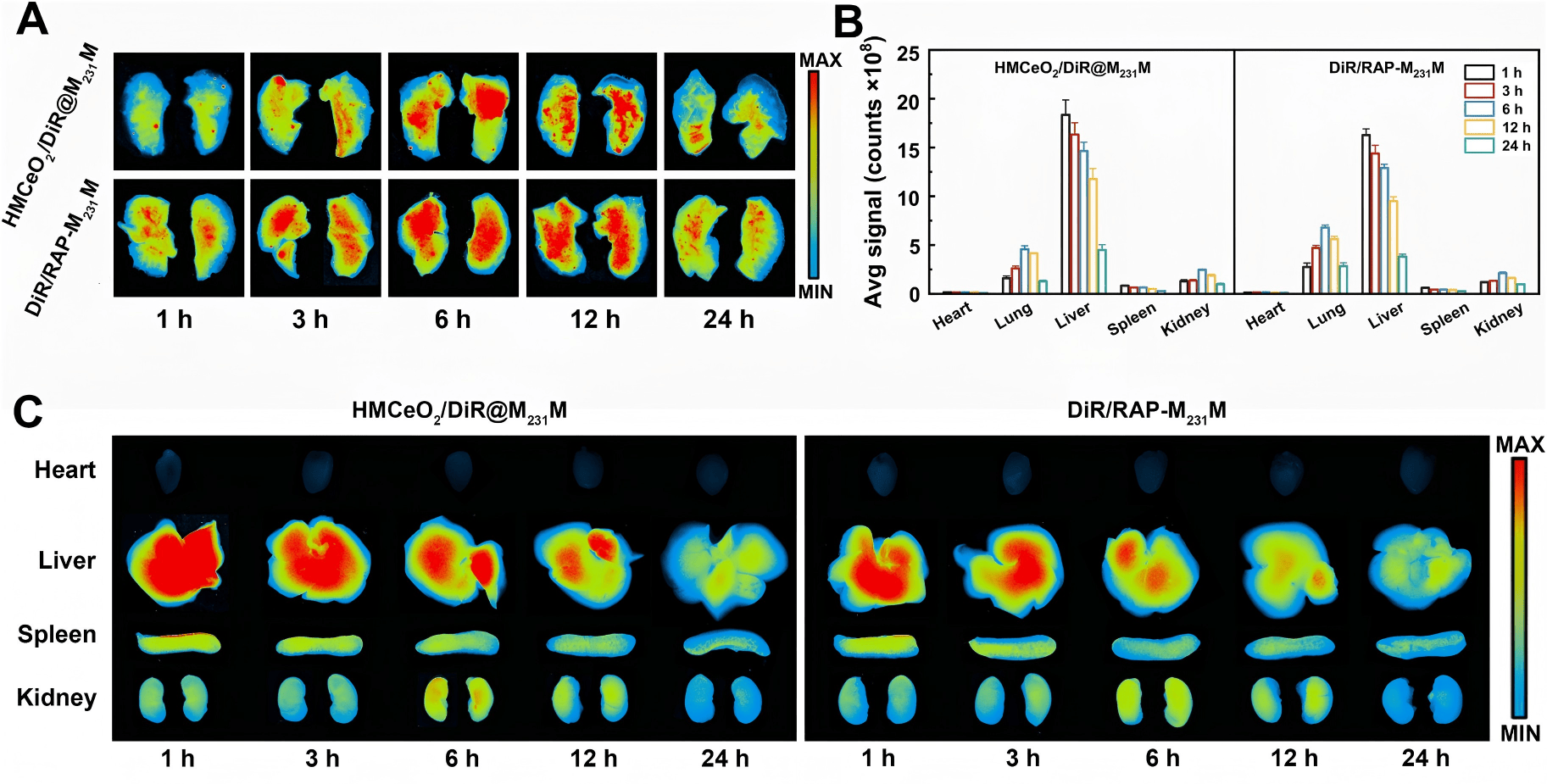
关键成果与意义
“该复合纳米平台使ALI小鼠的存活率在24小时内从73.3%惊人地提升至100%,并有效阻断了肺纤维化进程。”
这项研究不仅提出了一种创新的“细胞内/细胞外”协同治疗策略,更通过严谨的生物成像手段证实了仿生纳米载体的肺靶向能力。这为急性肺损伤及后续肺纤维化的临床治疗提供了极具潜力的新方案,同时也展示了高端活体成像设备在纳米药物研发中的核心价值。