研究背景:肿瘤异质性——一个移动的靶标
肿瘤并非由单一类型的癌细胞构成,其内部存在着巨大的异质性。不同亚群的细胞在增殖、侵袭和耐药性上表现各异,这种复杂性是导致癌症治疗失败和复发的主要原因。一个长期存在的关键问题是:肿瘤内部的细胞是如何相互“沟通”的?那些高度恶性的细胞,能否将它们的“坏习惯”传给相对“温和”的邻居,从而加速整个肿瘤的恶化?解答这个问题,需要在活体层面“亲眼看到”这一过程。
核心挑战:如何在活体内“捕捉”细胞间的秘密对话?
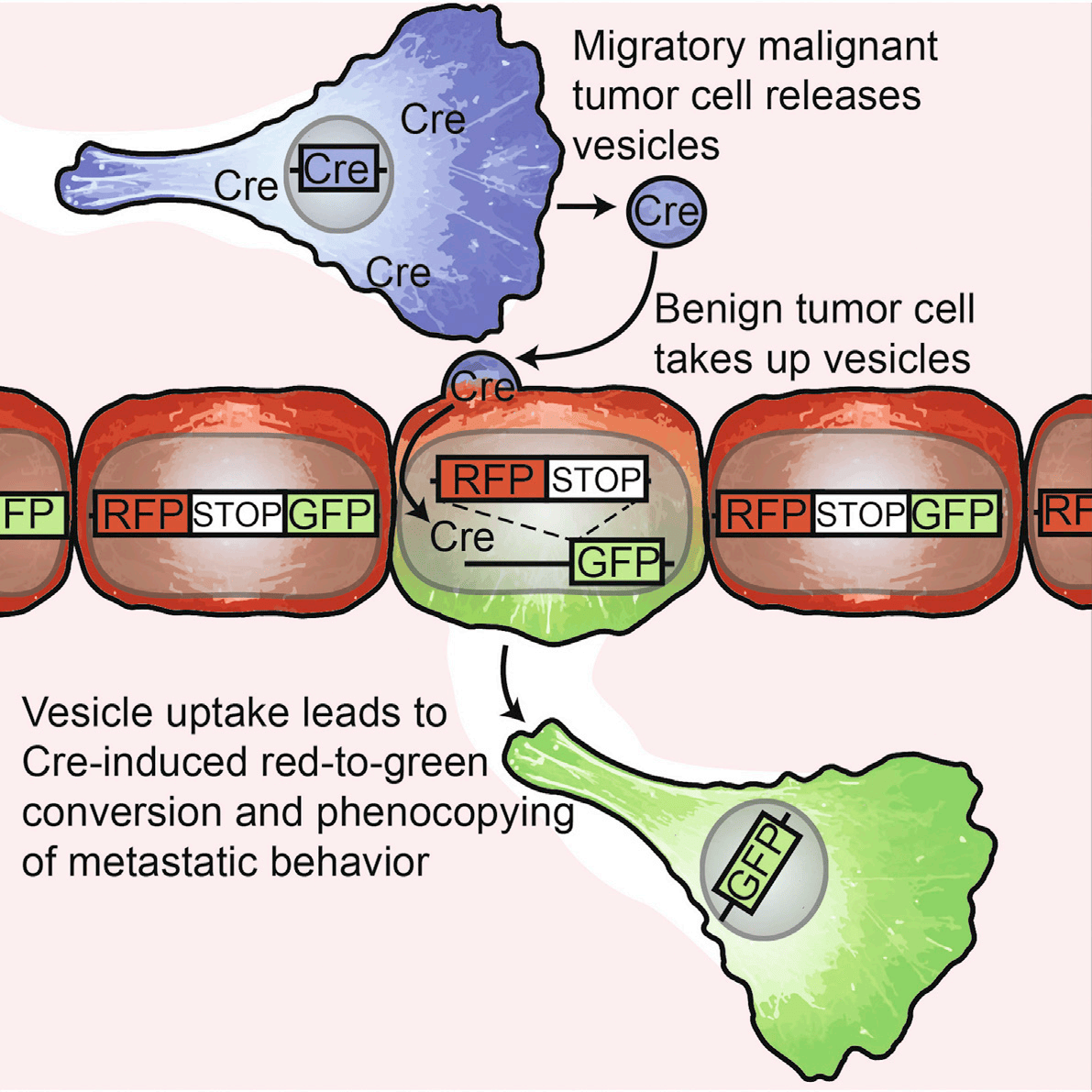
在培养皿中研究细胞通讯相对容易,但在一个包含亿万细胞、结构复杂的活体肿瘤中,要精确识别哪些细胞发出了信号、哪些细胞接收了信号,并证明这种信号传递直接导致了接收细胞的行为改变,无疑是大海捞针。研究者需要一种技术,不仅能区分不同来源的细胞,还能标记出“刚刚完成交流”的特定细胞,并对其进行长时间的动态行为追踪,这对成像技术的灵敏度、分辨率和多色分辨能力提出了极高的要求。
前沿技术路径与科辰星飞解决方案
为攻克这一难题,论文作者采用了先进的 intravital imaging (活体显微成像) 技术,实时追踪了Cre-LoxP系统介导的红绿荧光转换。这一思路为领域内研究者提供了宝贵借鉴。要开展类似的、涉及多种荧光蛋白(如本文中的CFP、DsRed、eGFP)的肿瘤转移活体成像研究,一台高性能的多光谱小动物活体荧光成像系统是成功的关键。科辰星飞的 LumiFluor AVIS X 6 小动物活体成像系统正是为应对此类挑战而设计的。其配备的高灵敏度深度制冷相机,结合专业级的窄带滤光片和先进的光谱拆分算法,能够最大限度地分离并识别不同荧光信号,即便在信号微弱或光谱重叠的情况下,也能确保数据的准确性,为研究人员清晰地呈现肿瘤微环境中复杂的细胞动态互作。对于需要长时间稳定成像的实验,配合使用 MZ-A小动物麻醉系统,可确保实验过程的平稳和数据的可重复性。
利用 LumiFluor AVIS X 6 活体成像系统开展同类研究的核心思路
- 第一步:荧光报告模型的构建与筛选:选择光谱间隔足够远、亮度高的荧光蛋白构建报告系统(如mCherry替代DsRed,mNeonGreen替代eGFP),并在体外验证系统的可靠性与转换效率。利用LumiFluor AVIS X 6的宽光谱成像能力,可以快速筛选出信噪比最佳的荧光探针组合。
- 第二步:多色肿瘤原位模型的建立:将两种或多种不同荧光标记的肿瘤细胞系(如“信号发出者”与“信号接收者”)以特定比例混合后,原位接种于小鼠(如乳腺脂肪垫),构建可供长期观察的肿瘤模型。
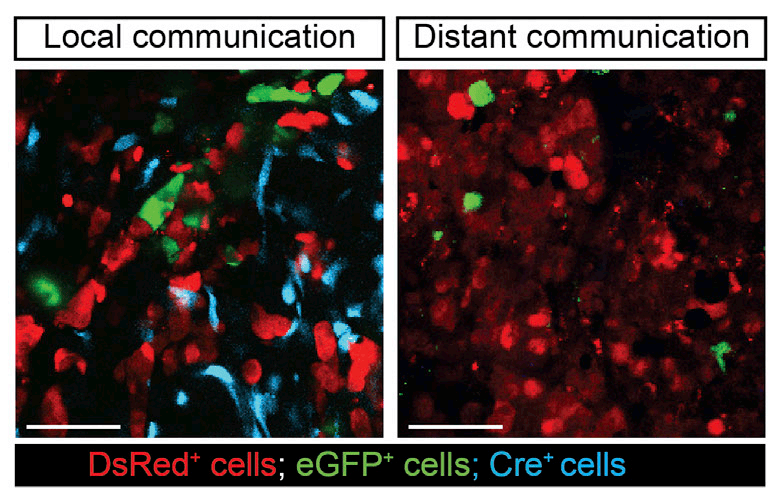
- 第三步:长时程、多通道成像序列的设定:在LumiFluor AVIS X 6系统中,为每种荧光蛋白设置最优的激发/发射滤片组合。制定合理的成像计划(例如,每24小时采集一次数据,持续2-3周),以动态追踪“信号接收者”中报告基因(如绿色荧光)的出现与增强,以及肿瘤整体的生长和转移情况。
- 第四步:图像分析与功能验证的结合:利用系统软件对连续采集的荧光信号进行定量分析,计算荧光转换的细胞比例。在实验终点,结合离体器官成像(如肺、肝),精确量化转移灶的数量和荧光来源,从而将活体观察到的细胞行为变化与最终的转移能力直接关联起来。
关键成果与科学意义
这项研究提供了直接的体内证据,表明肿瘤细胞之间可以通过细胞外囊泡进行局部和全身性的mRNA交换,从而导致接收细胞的转移行为被“复制”,深刻地改变了我们对肿瘤恶性演进的认识。
该研究的成功,不仅揭示了肿瘤进展的一个全新维度,更凸显了先进活体成像技术在生命科学前沿探索中的决定性作用。它将复杂的分子事件以直观的图像呈现在我们眼前,让“看见”成为“相信”的基石。科辰星飞致力于提供专业的活体成像系统解决方案,助力更多科研工作者突破技术瓶颈,在肿瘤学、免疫学、神经科学等领域做出更多突破性的发现。