研究背景:肠道“超级细菌”呼唤新型精准疗法
肠致病性大肠杆菌(E. coli)是全球范围内引发食源性疾病的主要元凶之一,严重威胁着人类健康和畜牧业发展。传统抗生素治疗不仅面临着日益严峻的耐药性问题,还可能破坏肠道内健康的微生物菌群。因此,开发一种能够精准“狙击”病原体,同时保护宿主的靶向治疗新策略,已成为该领域的迫切需求。
核心挑战:如何在复杂的肠道环境中实现“精准制导”?
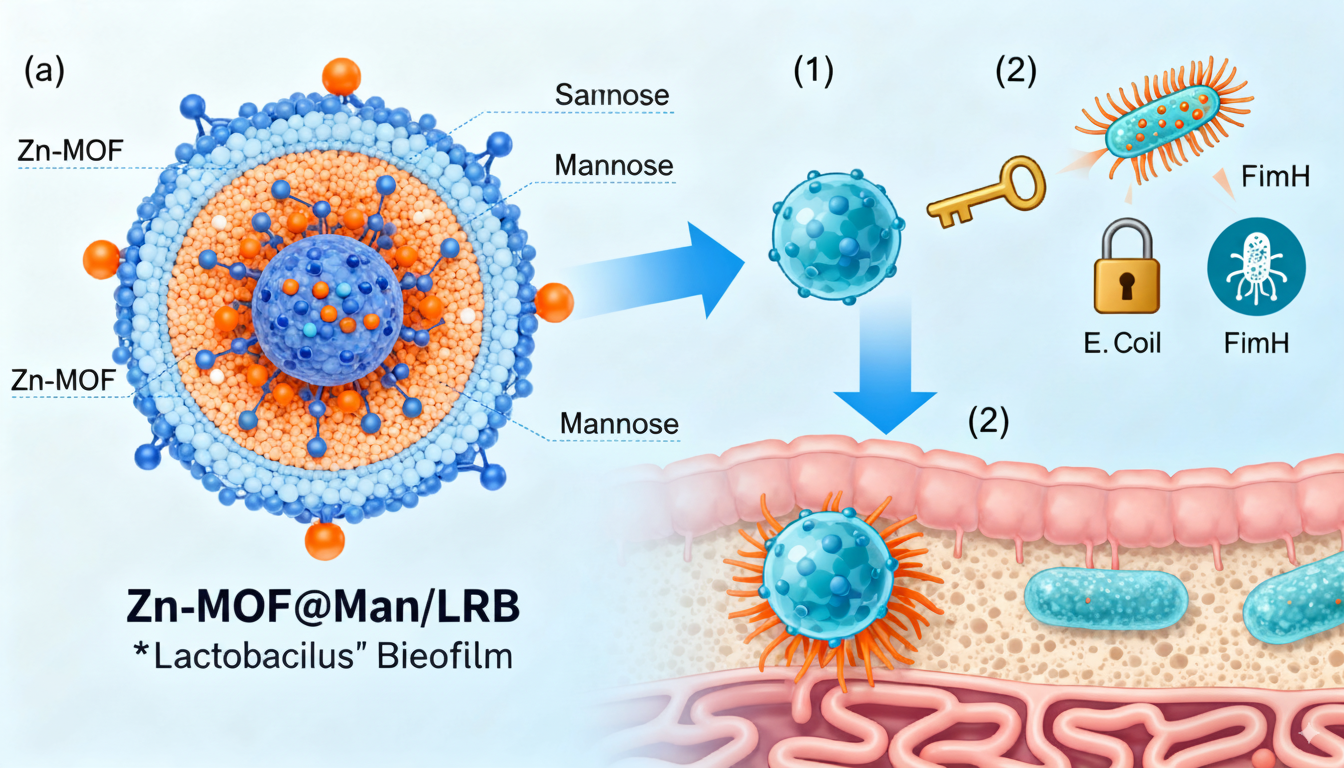
肠道是一个动态而复杂的环境,充满了消化液、黏液层和无数微生物。一个口服递送的药物要成功抵达感染部位并发挥作用,必须克服重重障碍。研究人员面临的核心挑战是:如何让治疗药物既能主动识别并结合 E. coli,又能牢固地附着在肠道黏膜上,实现药物的有效富集和持续释放?
技术路径解析与科辰星飞解决方案
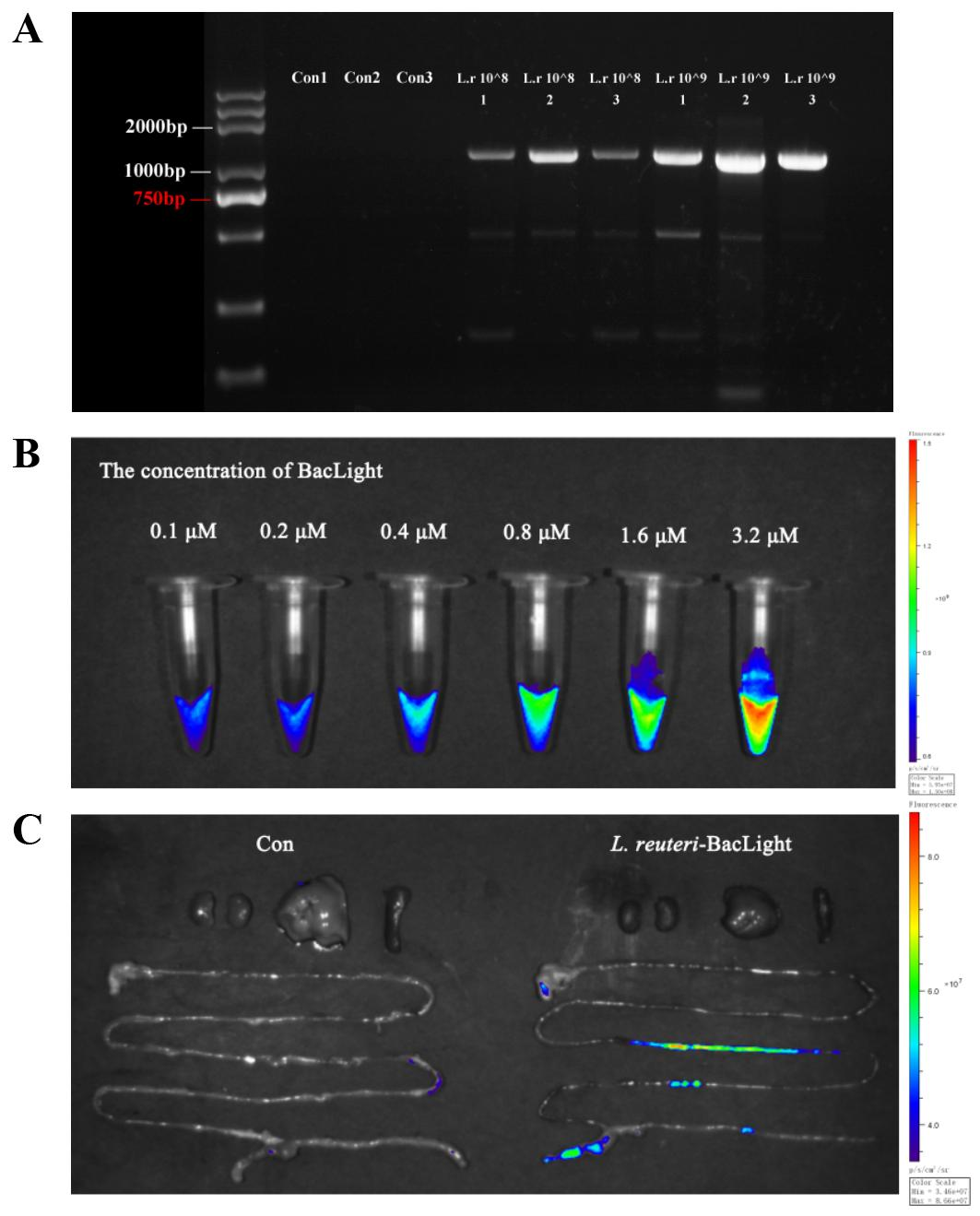
为此,中国农业大学马曦教授团队设计了一种巧妙的“一石二鸟”策略。他们构建了Zn-MOF@Man/LRB纳米系统,利用甘露糖(Man)作为“诱饵”,精准吸引 E. coli;再用亲和肠道的乳酸杆菌生物膜(LRB)作为“黏附外衣”,让整个系统能“定居”在肠道内。要验证这一设计的有效性,最直观的方法就是在活体动物模型中追踪其行踪。正如论文原文(第9页,264行)所述,研究人员正是使用科辰星飞(KoreShineFaye)成像系统成功捕获了纳米药物在小鼠肠道内靶向定植的关键荧光图像。这直接证明了我们的小动物活体成像技术,是确保此类前沿研究获得高可信度可视化证据的强大工具。
对于希望开展类似纳米药物体内示踪、肿瘤靶向性评估或细胞疗法研究的科研人员,我们推荐使用 LumiFluor AVIS X 6 小动物活体成像系统。该系统专为多色荧光与近红外成像优化,其高灵敏度背照式CCD相机和先进的光谱拆分技术,能够精准捕捉微弱的荧光信号,并有效分离自发荧光干扰,完美复现并优化本研究中的小鼠活体荧光成像实验。
使用 LumiFluor AVIS X 6 复现实验核心步骤
- 第一步:模型准备。构建 E. coli 感染的小鼠模型,并准备好经荧光探针(如Texas Red)标记的Zn-MOF@Man/LRB纳米药物。
- 第二步:给药与麻醉。通过口服灌胃方式给予小鼠荧光标记的纳米药物,并在预设的时间点(如4小时、24小时)使用科辰星飞的 MZ-A 小动物麻醉系统对小鼠进行稳定麻醉。
- 第三步:活体成像采集。将麻醉后的小鼠放入 LumiFluor AVIS X 6 的成像暗箱中,选择合适的激发光源和发射滤光片,进行腹部荧光成像,实时观察纳米药物在肠道内的分布和聚集情况。
- 第四步:离体成像验证。在实验终点,采集小鼠的主要脏器(肝、脾、心、肾、肠道等),在成像系统内进行高分辨率离体荧光成像,精确定量纳米药物在各器官的富集程度,验证其肠道靶向性。
关键成果与意义
这项研究不仅为治疗细菌性肠炎提供了一种高效、安全的非抗生素策略,更重要的是,通过小动物活体成像等可视化技术,清晰地展示了复杂的纳米递送系统在体内的真实行为,为未来智能药物的设计提供了宝贵的范例和验证平台。
总而言之,这项发表在顶级期刊 Advanced Materials 上的研究,不仅是纳米医学领域的重大突破,也再次印证了先进的成像技术是连接巧妙分子设计与成功体内应用的桥梁。科辰星飞将持续提供高性能、高可靠性的活体成像系统,助力更多科学家将创新的想法转化为改变未来的现实。