研究背景:免疫治疗的“读心术”挑战
癌症免疫治疗通过激活患者自身的免疫系统来对抗肿瘤,已成为继手术、放疗、化疗后的第四大支柱。然而,仅有部分患者能从中获益,且个体反应差异显著。如何在治疗早期就“读懂”免疫系统是否被有效激活,从而预测疗效并及时调整方案,是当前精准肿瘤学面临的关键瓶颈。现有检测手段,如组织活检,具有侵入性且无法反映动态变化;而传统的光学成像则受限于组织穿透深度和背景信号干扰,难以用于深部肿瘤的精准定量评估。
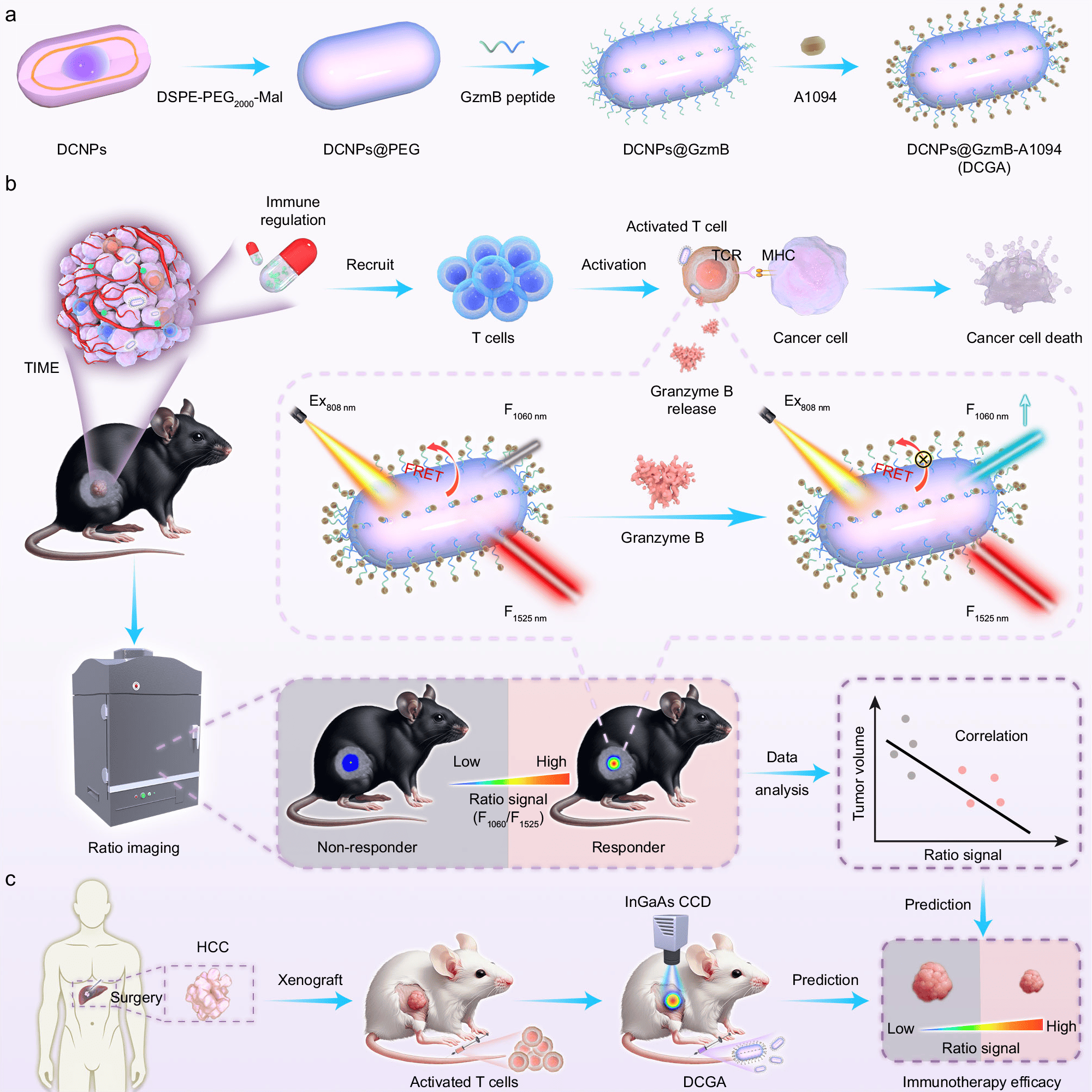
技术突破:NIR-II比率成像,为免疫激活装上“双保险”
为攻克上述难题,该研究团队独辟蹊径,设计了一种基于稀土纳米颗粒的近红外二区(NIR-II,1000-1700 nm)比率荧光探针(DCGA)。NIR-II窗口的光具有更低的组织散射和自发荧光,确保了更深的穿透能力和更高的信噪比。更巧妙的是,该探针包含两种发射光:一种在1060 nm,其信号会被T细胞杀伤肿瘤时释放的粒酶B(GzmB)“点亮”;另一种在1525 nm,其信号始终保持稳定,作为内部参考。通过计算这两种信号的比值(F1060/F1525),研究者可以消除因探针浓度、分布不均等因素造成的误差,实现对免疫活性的精确定量,如同为信号的准确性上了一道“双保险”。
前沿技术路径与科辰星飞解决方案
论文中利用近红外二区比率荧光成像技术,成功实现了深部肿瘤免疫微环境的动态、无创与精准可视化。这一前沿技术路径对成像设备提出了极高的要求,这正是科辰星飞 NIR-Ⅱ AVIS 小动物近红外二区活体成像系统的核心优势所在。该系统专为NIR-II波段优化,搭载了高灵敏度的InGaAs相机和覆盖1000-1700 nm的专用滤光片组,能够高效、清晰地捕捉到论文中提及的1060 nm和1525 nm处的微弱荧光信号。其先进的分析软件内置了比率运算功能,可轻松实现双通道图像的像素级配准与比值计算,为开展同类高端免疫治疗监测研究提供了从硬件到软件的完整解决方案。
利用 NIR-Ⅱ AVIS 小动物近红外二区活体成像系统 开展同类研究的核心思路
- 探针筛选与光谱验证:在正式动物实验前,利用系统对备选的比率探针进行体外光谱特性分析,确认其在NIR-II区的响应信号峰(如1060 nm)和参考信号峰(如1525 nm)位置准确,并验证其对目标激活物(如粒酶B)的特异性响应。
- 动物模型与给药优化:建立相应的肿瘤免疫治疗动物模型(如Hepa 1-6或PDX模型)。通过预实验,确定探针的最佳给药剂量、给药途径(如尾静脉注射)以及成像时间窗口,找到探针在肿瘤区域富集且背景信号最低的最佳拍摄时机。
- 双通道图像序列采集:在进行纵向研究时,为每个成像时间点(如治疗后第3、6、9天)设置标准化的双通道图像采集序列。首先采集1525 nm的参考通道图像,随后采集1060 nm的响应通道图像,确保曝光时间、增益等参数的一致性,为精确的比率分析奠定基础。
- 比率图像生成与定量分析:利用系统自带的分析软件,将同一时间点采集的双通道图像进行叠加和比率计算(F1060/F1525)。软件会自动生成伪彩比率图,直观地展示免疫激活的热点区域。随后,通过ROI(感兴趣区域)圈定肿瘤区域,进行定量统计,获得比率信号的平均强度值。
- 多维度数据关联分析:将连续监测获得的比率信号变化曲线,与肿瘤体积、小鼠体重、生存期以及终末点的组织免疫组化(如CD8+ T细胞浸润)等数据进行关联分析,以验证小动物活体成像结果作为免疫治疗早期预测生物标志物的可靠性与准确性。
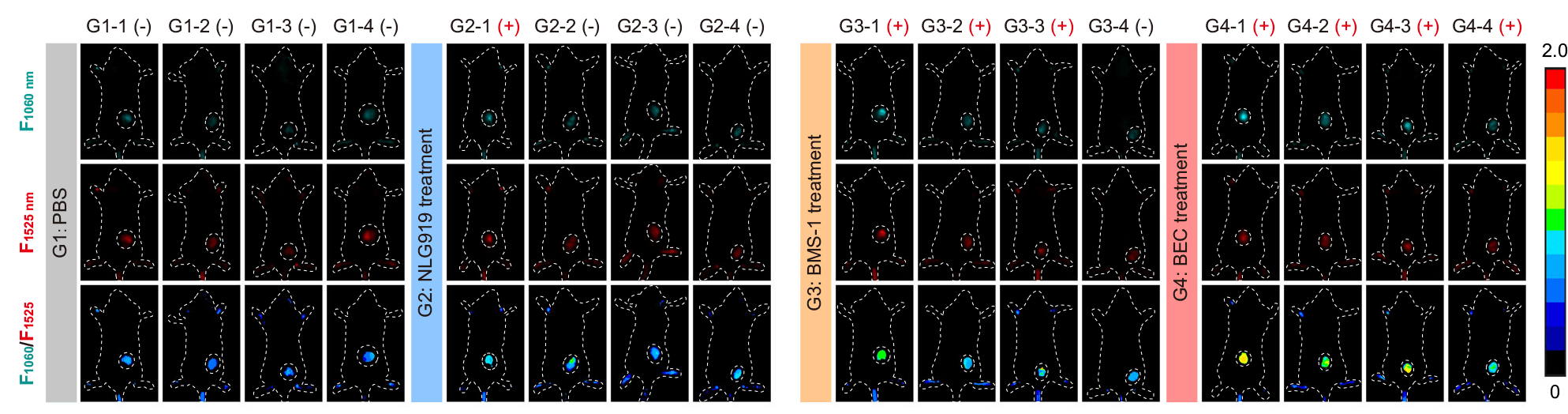
关键成果与科学意义
我们的DCGA探针为深层组织中T细胞活化的动态、实时、无创分子成像带来了希望,为肿瘤免疫治疗研究、精准医学和个性化诊断提供了有效支持。
这项发表在《Nature Communications》上的研究,不仅提供了一种强大的新型成像工具,更重要的是,它验证了一种能够提前预知免疫治疗成败的创新策略。通过无创地“看见”免疫细胞的工作状态,研究人员可以在数天内就对疗效做出判断,这比等待数周观察肿瘤是否缩小要高效得多。这对于指导临床用药、筛选优势治疗方案、开发新型免疫药物具有里程碑式的意义。科辰星飞致力于提供如 NIR-Ⅱ AVIS 这样的前沿小动物活体成像系统,赋能更多科研人员投身于此类改变游戏规则的创新研究,共同推动精准医疗的边界。