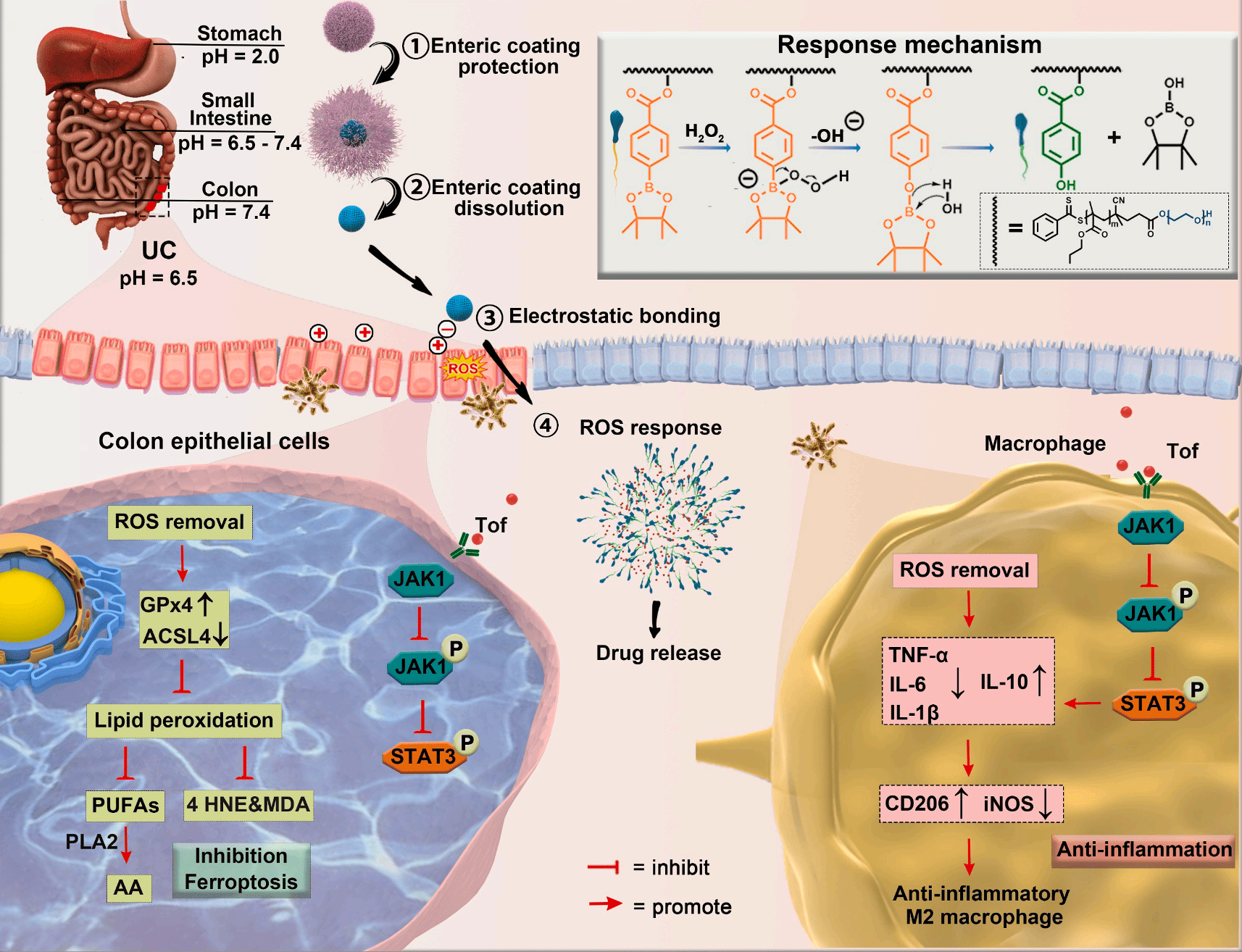
研究背景:攻克“难缠”的溃疡性结肠炎
溃疡性结肠炎(UC)是一种慢性的、终身性的结直肠炎症性疾病,严重影响患者的生活质量。尽管现有多种药物可以缓解症状,但传统的口服给药方式常因胃酸破坏、肠道非特异性吸收等问题导致药物无法足量到达病灶,为达到疗效而增加剂量又会引发严重的副作用。因此,开发一种能精准靶向病变结肠的口服药物递送系统,是该领域亟待突破的难题。
核心挑战:如何“看见”纳米药物的体内靶向之旅?
研究团队设计的纳米药物在理论上堪称完美,但“耳听为虚,眼见为实”。在进入复杂的生物体内后,这种纳米药物是否真的能如预期那样“过关斩将”,精准抵达发炎的结肠?又能在那里停留多久?要回答这些药物开发中的关键问题,就必须有一种能够无创、动态、实时追踪药物在活体动物内部分布的技术。这正是小鼠活体成像技术发挥核心作用的地方。
技术路径解析与科辰星飞解决方案
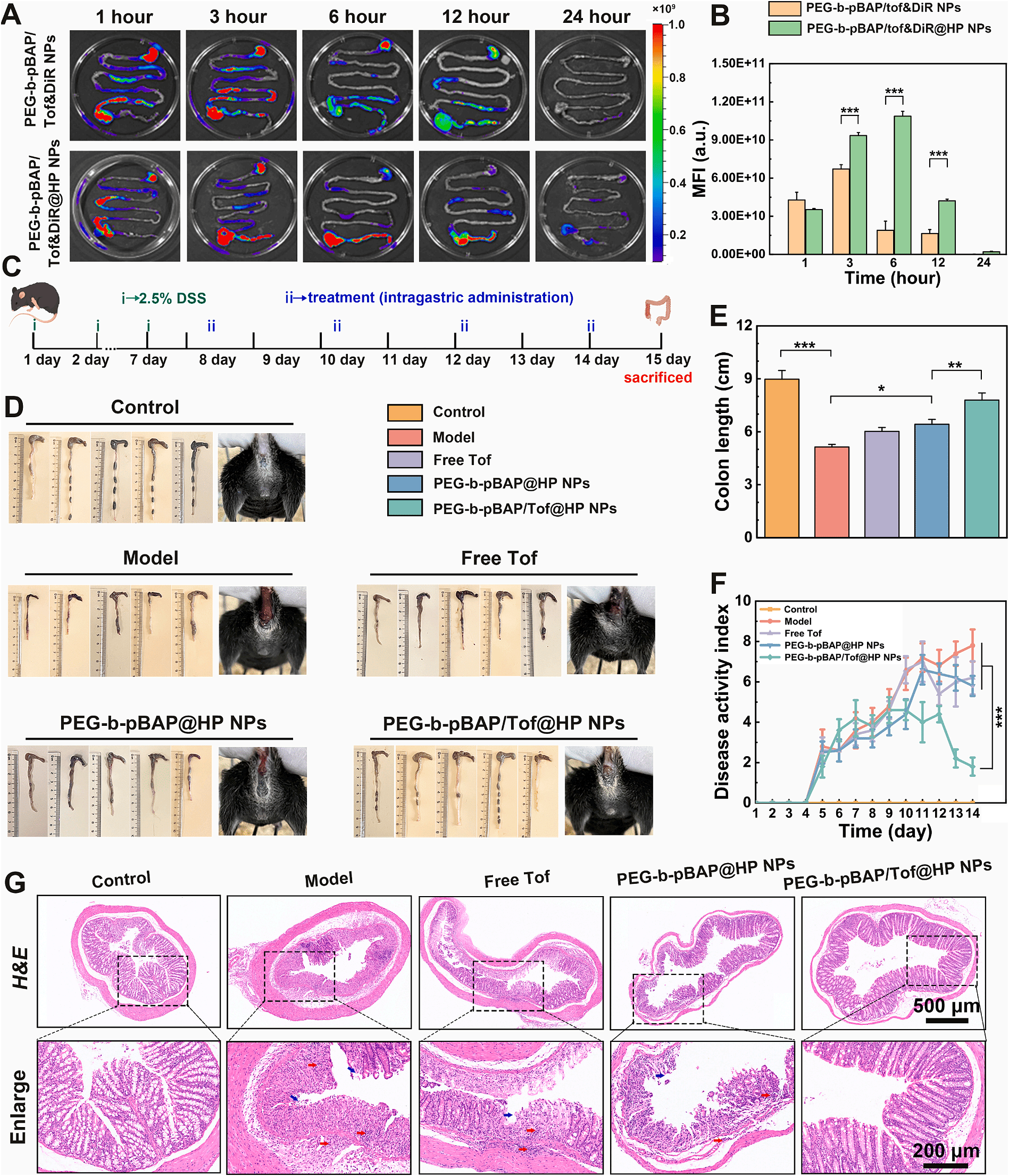
为了实现药物可视化追踪,研究人员将近红外荧光染料DiR(一种在深层组织中穿透性好的染料)装载到纳米药物中。通过口服给药后,在不同时间点对UC模型小鼠进行活体荧光成像。这项关键的验证性实验,与科辰星飞的 LumiFluor AVIS T 小动物活体成像系统 的设计理念和核心功能高度契合。该系统配备了高灵敏度的深度制冷CCD相机和针对近红外优化的滤光片组,能够精准捕捉深部组织(如结肠)发出的微弱荧光信号,并通过专业的分析软件进行精确定量,是评估和优化靶向递送系统的强大工具。
使用 LumiFluor AVIS T 小动物活体成像系统 复现实验核心步骤
- 第一步:模型与给药:构建DSS诱导的UC小鼠模型,通过灌胃方式给予负载了近红外探针DiR的纳米药物。
- 第二步:动物准备与成像设置:使用配套的小动物麻醉机对小鼠进行稳定麻醉后,放入LumiFluor AVIS T成像暗箱。选择DiR对应的激发光源与发射滤光片(例如激发740nm/发射790nm),设置合适的曝光时间和视场。
- 第三步:多时间点动态成像:在给药后的1、3、6、12、24小时等关键时间点,对小鼠进行腹部活体成像,实时记录并观察荧光信号在消化道内的分布和迁移情况。
- 第四步:离体验证与定量分析:在最后一个时间点牺牲小鼠,取出完整的消化道及主要脏器进行离体成像,以获得更精确的分布信息。利用系统软件的ROI(感兴趣区域)功能,圈定胃、小肠、结肠等区域,定量分析各部位的平均荧光强度,绘制药物体内分布的时间-荧光强度曲线。
关键成果与科学意义
这项研究通过巧妙的纳米设计与可靠的活体成像验证,成功开发了一种具有临床转化潜力的口服UC治疗新策略,为精准靶向递送系统的研究提供了新的范例。
该研究的成功,不仅为溃疡性结肠炎的治疗带来了新希望,也再次凸显了先进的活体成像技术在现代药物研发中的核心地位。从药物设计、体内行为确认到药效评估,如LumiFluor AVIS T这样高性能、高稳定性的活体成像系统,能够为科研人员提供直观、可靠的决策依据,从而大大加速创新疗法的转化进程。