引言:突破血胰屏障的治疗挑战
重症急性胰腺炎(SAP)是一种致死率极高的急腹症,其治疗面临着巨大的挑战:深在的解剖位置和难以逾越的血胰屏障(BPB),使得常规药物难以到达受损的胰腺腺泡细胞(PACs)。近日,中国海洋大学研究团队在生物材料领域顶级期刊《Acta Biomaterialia》上发表了题为“Tailored 'Three-stage booster' nano-extinguisher for synergistic treatment of severe acute pancreatitis”的研究论文,提出了一种创新的“三级助推”纳米药物递送策略,为这一临床难题带来了新的曙光。
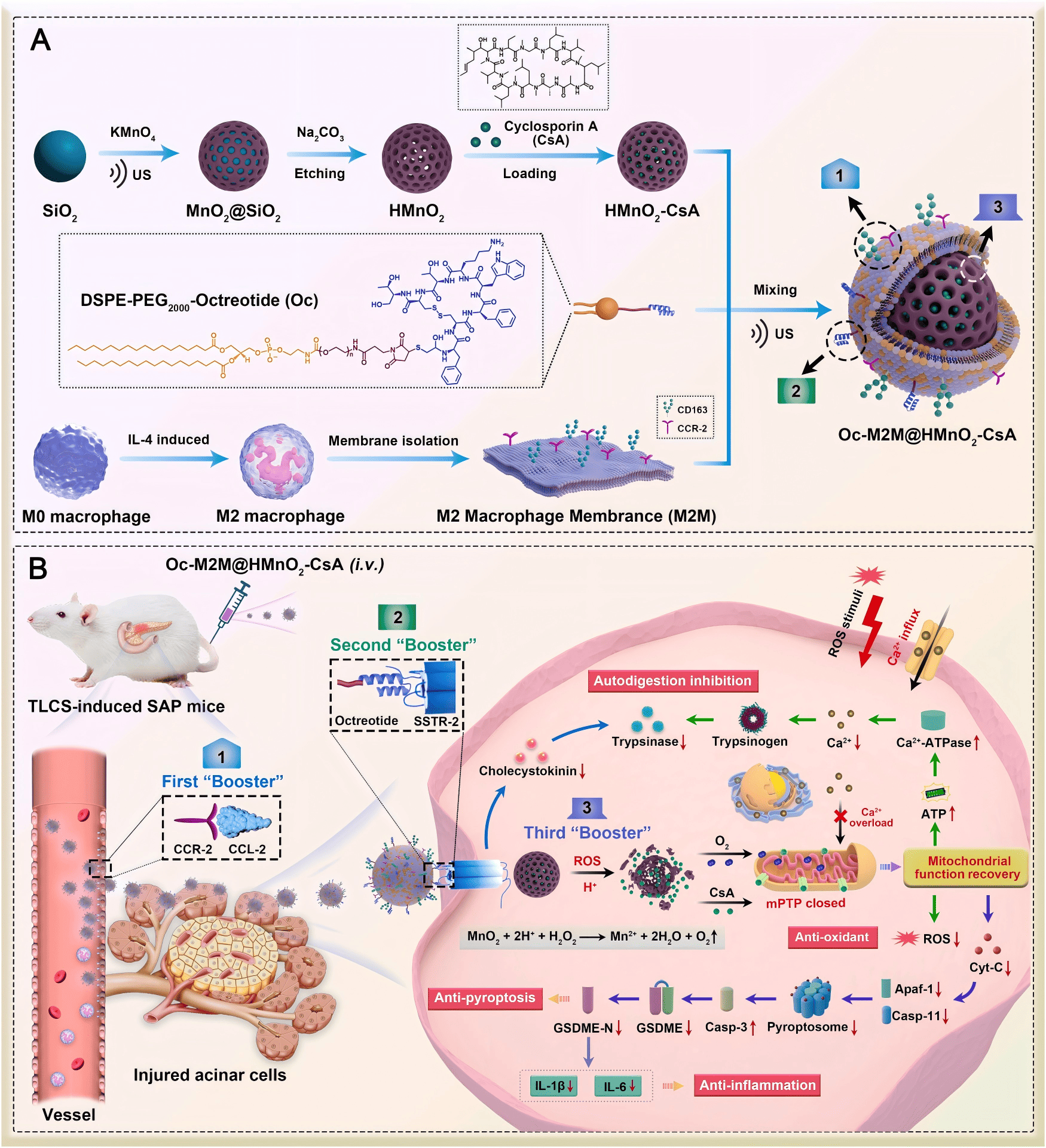
核心亮点:“内阻外修”的精准纳米灭火器
该研究构建了一种名为 Oc-M2M@HMnO2–CsA 的仿生纳米药物。研究人员利用 M2 型巨噬细胞膜和奥曲肽(Oc)对纳米颗粒进行双重修饰,使其具备了“三级助推”的靶向能力:第一级靶向受损血管内皮,第二级穿透血胰屏障精准定位腺泡细胞,第三级进入细胞内部修复线粒体。这种机制不仅在外部抑制了胰腺的“自身消化”,更在内部通过响应微环境释放环孢素 A(CsA)和氧气,修复线粒体功能障碍,阻断细胞焦亡通路。
见证“靶向”:LumiFluor 活体成像系统的关键佐证
在纳米药物的研发中,如何证明药物真正跨越了屏障并富集在目标器官,是评估药效的关键一环。在本项研究中,科辰星飞的LumiFluor AVIS T II 小动物活体成像系统发挥了至关重要的作用。研究团队利用该系统对小鼠的心、肝、脾、肺、肾及胰腺进行了高精度的离体生物分布成像(Ex vivo biodistribution)。
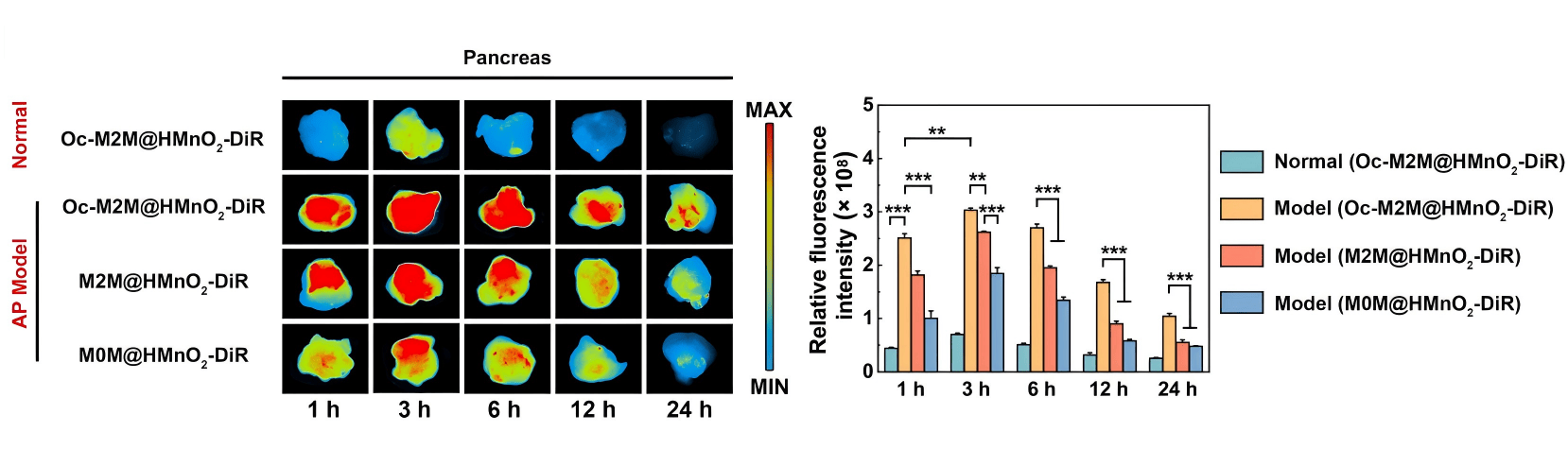
得益于 LumiFluor AVIS T 系统卓越的荧光灵敏度和背景噪音抑制能力,成像结果清晰地显示:相比于普通纳米粒,经过修饰的“三级助推”纳米药物在受损胰腺组织中的荧光信号显著增强,且在注射后 24 小时仍保持高滞留量。这一影像学证据直观、有力地证实了该纳米载体优异的靶向性能,为后续的疗效分析奠定了坚实基础。
本文核心要点
- 创新机制:构建了“三级助推”仿生纳米平台,成功突破血胰屏障,实现对受损胰腺腺泡细胞的精准递送。
- 影像验证:利用科辰星飞 LumiFluor AVIS T 系统,清晰捕捉到药物在胰腺的特异性富集,验证了靶向策略的有效性。
- 卓越疗效:该疗法将 SAP 小鼠的生存率从 41.7% 提升至 91.7%,并显著降低了细胞凋亡率,实现了胰腺功能的快速恢复。
“该仿生纳米制剂通过纠正线粒体功能障碍和抑制胰腺自身消化,为临床环境中重症急性胰腺炎的管理提供了一种有前景的上游治疗策略。” —— 摘自论文原文
行业影响与未来展望
这项研究不仅为重症急性胰腺炎的治疗提供了新思路,也展示了先进的光学成像技术在复杂药物递送系统研发中的核心价值。科辰星飞致力于为生命科学研究提供最前沿的 小动物活体成像系统解决方案,无论是深层组织成像还是多模态示踪,我们的 LumiFluor 系列产品都将持续助力科研工作者探索未知,加速药物从实验室走向临床的进程。