小动物活体成像与代谢组学跨模态融合的技术路径与临床转化前景
在生物医学研究中,小动物活体成像技术与代谢组学的结合正开启一场“数据驱动”的科学革命。活体成像能够实时捕捉肿瘤生长、药物分布等动态过程,而代谢组学则从分子层面解析生物代谢网络的全局变化。二者的跨模态融合,不仅为疾病机制研究提供多维视角,更在精准医疗和药物开发中展现出巨大潜力。本文从技术路径与临床转化出发,解析这一融合趋势的科学逻辑与应用前景。
技术路径:从硬件协同到数据整合
传统活体成像技术(如荧光、生物发光)擅长功能成像,但难以揭示代谢物的空间分布;代谢组学虽能高通量检测代谢物,却缺乏时空分辨率。跨模态融合的第一步,是通过硬件整合实现数据同步采集。
数据整合:AI驱动的多组学关联分析
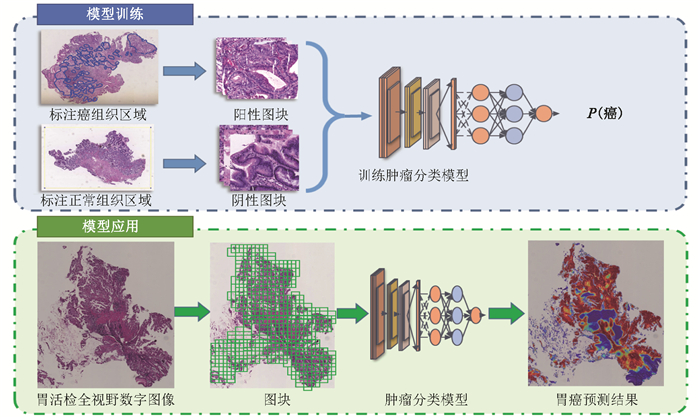
跨模态数据的核心挑战在于异构数据的标准化与关联。清华大学胡泽平团队的研究为此提供了范例:他们通过机器学习模型,将代谢组学数据(如谷胱甘肽代谢通路异常)与活体成像的动态特征(如肿瘤体积变化)关联,构建了胃癌诊断和预后预测模型,灵敏度达92.5%610。这种“成像-代谢-算法”的三元整合,可精准识别疾病标志物并预测治疗响应。
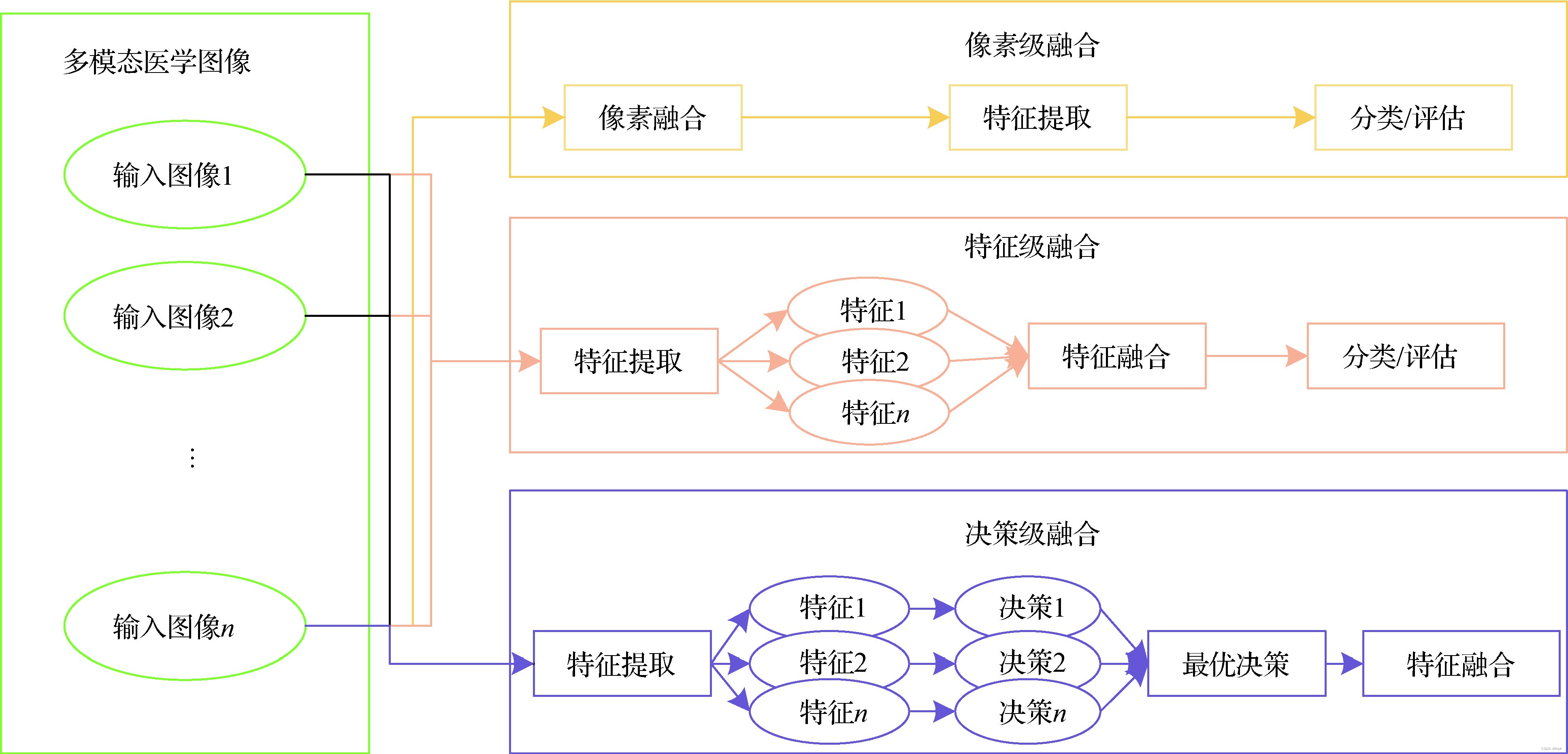
算法优化:从降噪到空间配准

临床转化前景:从实验室到病床
传统胃癌诊断依赖侵入性内镜活检,而代谢组学结合活体成像的跨模态技术,可通过血液代谢标志物(如GSH/GSSG比值)和影像特征实现无创早期筛查。胡泽平团队的模型对早期胃癌(stage IA)的诊断灵敏度显著优于传统蛋白标志物(如CEA),为临床提供了更安全、高效的工具610。在治疗层面,融合技术可实时监测CAR-T细胞疗法的靶向效率,或追踪纳米药物在肿瘤内的分布,为剂量调整提供依据。
药物开发:加速靶点发现与药效评估
代谢重编程是肿瘤耐药的重要机制。通过活体成像动态观察肿瘤代谢变化(如葡萄糖摄取异常),结合代谢组学解析关键通路(如三羧酸循环紊乱),可快速筛选药物靶点。
疾病机制:解析代谢-影像关联网络
在神经退行性疾病研究中,活体成像可捕捉脑内淀粉样蛋白沉积的时空动态,而代谢组学则揭示伴随的氧化应激和能量代谢异常。二者结合,不仅能定位病变区域,还能阐明代谢失衡如何驱动病理进程,为干预策略提供新思路。
未来趋势:智能化与标准化
1.智能决策系统:集成实时成像数据与代谢组学数据库,自动推荐最优实验参数或治疗策略。例如,AI可根据肿瘤代谢特征预测放疗敏感性,并动态调整成像方案以监测疗效。
2.标准化数据生态:建立多中心共享的代谢-影像数据库,统一数据格式与质控标准。迈维代谢与药物所的合作已初步构建空间代谢质谱数据库,为跨机构研究奠定基础。
